a cura di Francesco Spagnolo
I farmaci a bersaglio molecolare e l’immunoterapia hanno rivoluzionato il trattamento del melanoma avanzato. Grazie all’utilizzo di questi farmaci è possibile ottenere risposte durature in un elevato numero di pazienti, migliorandone la sopravvivenza a lungo termine e la qualità di vita. Tuttavia, non tutti i pazienti ottengono lo stesso beneficio e non è ancora chiaro per quali pazienti sia più vantaggioso il trattamento in prima linea con la terapia “target” piuttosto che con l’immunoterapia.
La presenza della mutazione di BRAF è necessaria per l’utilizzo degli inibitori di BRAF in combinazione con inibitori di MEK, appartenenti alla categoria dei farmaci a bersaglio molecolare o “targeted therapy”. La mutazione di BRAF, riscontrata in circa la metà di tutti i melanomi non uveali, costituisce pertanto un fattore predittivo di risposta alla terapia con inibitori di BRAF+MEK: la maggior parte dei pazienti con la mutazione di BRAF (>80%) ottiene una regressione del tumore grazie al trattamento, mentre in assenza della mutazione non si può utilizzare questa terapia. Il ruolo prognostico di BRAF, ossia la sua associazione con una migliore o peggiore sopravvivenza indipendentemente dal tipo di trattamento, è, invece, controverso: alcune casistiche hanno osservato un comportamento biologico più aggressivo in caso di presenza della mutazione di BRAF, mentre altri studi non hanno rilevato differenze significative con melanomi che non presentavano una mutazione di BRAF. Anche il ruolo prognostico della mutazione di NRAS, riscontrata in circa il 15-20% di tutti i melanomi non uveali e la seconda mutazione più frequente dopo BRAF, non è ancora definito, con i dati delle varie casistiche che puntano in direzioni diverse.
Il valore basale della lattato deidrogenasi (LDH), un enzima citoplasmatico che può aumentare nel sangue in risposta ad un danno cellulare e che viene rilasciato da tumori in rapida crescita, rappresenta in tutti gli studi clinici sul melanoma avanzato uno dei principali fattori prognostici. In un’analisi aggregata dei dati degli studi di fase 3 con gli inibitori di BRAF e MEK dabrafenib e trametinib, si è osservato che il valore basale di LDH era il marcatore prognostico che meglio correlava con la sopravvivenza globale, con il 55% dei pazienti vivi a 3 anni nel gruppo con LDH nella norma contro il 22% del gruppo con LDH elevato. Per quanto riguarda la sopravvivenza libera da progressione, oltre ai valori di LDH sono stati riscontrati anche marcatori prognostici clinici che identificavano gruppi di pazienti a diversa prognosi: il numero di organi coinvolti dalle metastasi, la somma dei diametri delle lesioni e il performance status del paziente. Risultati simili sono stati ottenuti anche per vemurafenib e cobimetinib, un’altra combinazione di inibitori di BRAF e MEK. Anche nei pazienti trattati con l’immunoterapia il valore basale di LDH rappresenta uno dei fattori prognostici più importanti: nello studio di fase 3 Checkmate-067, il 54% dei pazienti trattati con l’anticorpo anti-PD-1 nivolumab erano vivi a 4 anni se il valore basale di LDH era normale, contro il 31% in caso di LDH elevato. Il ruolo prognostico dell’LDH è così rilevante da essere incluso nella stadiazione del melanoma dell’American Joint Committee on Cancer (AJCC). Rimanendo nell’ambito dei biomarcatori plasmatici e sierologici, che hanno il vantaggio di essere facilmente accessibili e indipendenti dall’eterogeneità tumorale, diversi studi indicano un ruolo importante del rapporto neutrofili/linfociti e della composizione delle sottopopolazioni linfocitarie, dei livelli di proteina C reattiva, della presenza di fattori solubili come il sCTLA-4 e sPD-L1, della quantità e qualità di alcune citochine.
Oltre ai già citati performance status e al carico tumorale, un marcatore clinico di grande rilevanza è la presenza di metastasi encefaliche, che caratterizza un gruppo di pazienti a prognosi più sfavorevole, in particolare quando queste sono sintomatiche. In questo sottogruppo di pazienti, le terapie ottengono risultati sub ottimali.
Alcuni importanti biomarcatori riguardano le caratteristiche immunologiche del tumore e del microambiente tumorale. In particolare, l’espressione di PD-L1 da parte delle cellule tumorali, ma anche delle cellule T CD8+ che infiltrano il tumore, sembra ricoprire un ruolo prognostico molto importante nei pazienti con melanoma avanzato, oltre che un potenziale effetto predittivo di risposta al trattamento con anticorpi anti-PD-1. Un’analisi su 451 pazienti arruolati in uno studio di fase 1 con pembrolizumab ha mostrato che all’aumentare dell’espressione di PD-L1 aumentavano il tasso di risposte, la sopravvivenza libera da progressione e la sopravvivenza globale. Tuttavia, anche in caso di assenza dell’espressione di PD-L1, i pazienti con melanoma avanzato possono comunque ottenere un beneficio clinico anche duraturo in seguito al trattamento con anti-PD-1, che è pertanto indicato nel melanoma avanzato indipendentemente dal livello di espressione di PD-L1. Più chiaro sembra essere invece il ruolo prognostico di PD-L1, associato infatti alla sopravvivenza globale dei pazienti con melanoma avanzato indipendentemente dal trattamento ricevuto. Altri tra i biomarcatori tissutali più studiati sono la densità e la qualità dell’infiltrato linfocitario tumorale, il carico mutazionale totale ed il relativo carico di neoantigeni e l’espressione delle molecole del complesso di istocompatibilità maggiore. I problemi generali associati allo studio e all’utilizzo dei biomarcatori tissutali sono dovuti alla ben documentata eterogeneità inter- e intra-tumorale ed ai cambiamenti dinamici di alcuni marcatori, in particolare dell’espressione di PD-L1, con risultati dipendenti dal sito e dal “timing” della biospia.
In conclusione, nonostante la presenza di numerosi biomarcatori prognostici e, potenzialmente, predittivi di risposta ad un trattamento, non esiste ad oggi la possibilità di individuare la più corretta strategia terapeutica (in particolare, la migliore sequenza di terapie a bersaglio molecolare e immunoterapia) sulla base di biomarcatori clinici, plasmatici e tissutali (Tabella 1). Anche in vista della disponibilità di nuove terapie e di nuove combinazioni di trattamenti, le sfide future riguarderanno l’implementazione di nuove tecniche, come la biopsia liquida, e lo sviluppo e validazione di test multi-parametrici in grado di guidare il clinico nella personalizzazione delle strategie terapeutiche.
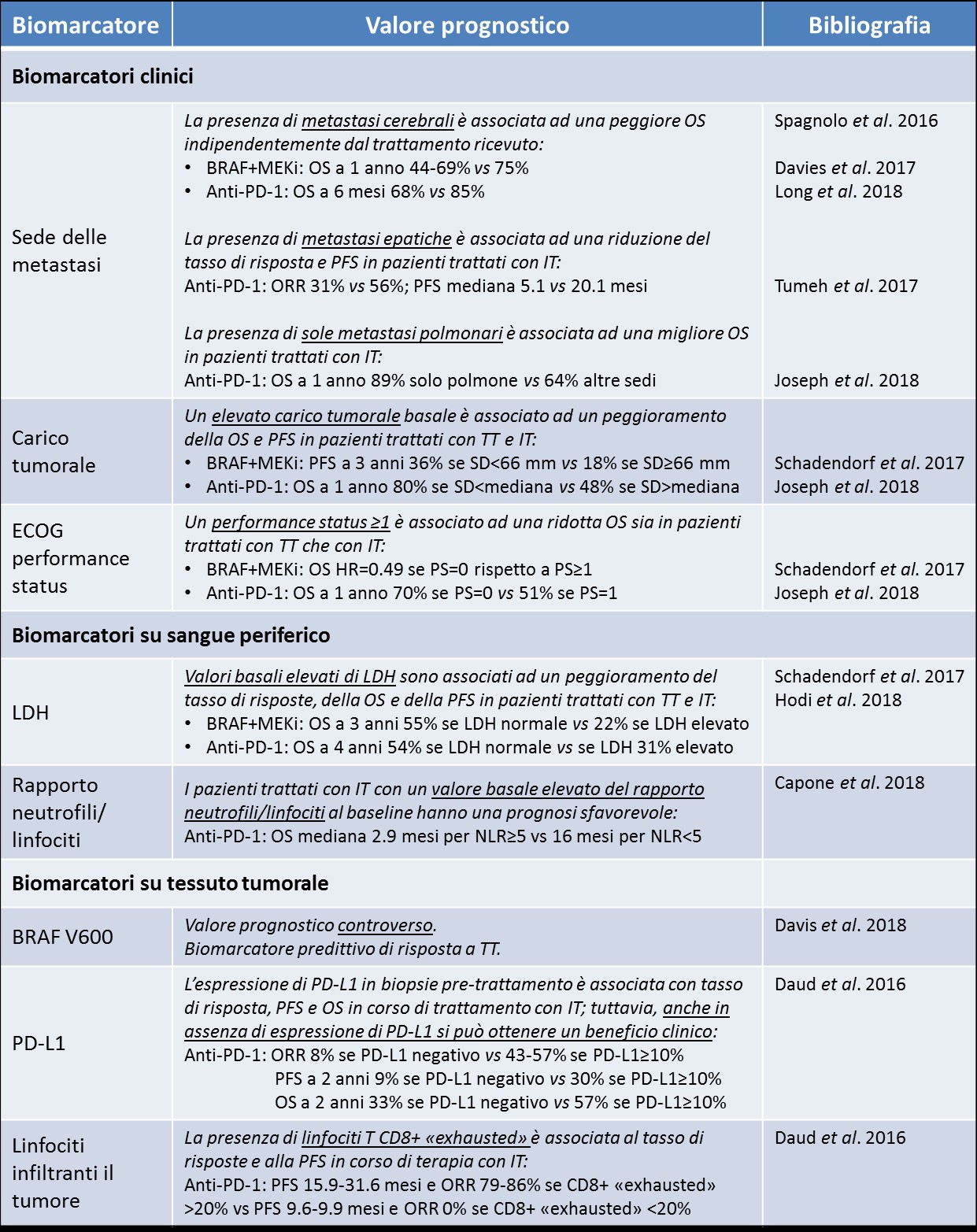
Tabella 1. Ruolo dei principali biomarcatori prognostici nel trattamento del melanoma avanzato.
HR: hazard ratio; IT: immunoterapia; NLR: rapporto neutrofili/linfociti; ORR: tasso di risposta; OS: sopravvivenza globale; PFS: sopravvivenza libera da malattia; PS: performance status; SD: somma dei diametri delle lesioni; TT: terapie a bersaglio molecolare

